Organoides intestinales para el estudio de infecciones
Las líneas celulares y los modelos animales han sido ampliamente utilizados en la investigación biomédica para intentar reproducir, en los laboratorios, algunas de las condiciones de los tejidos humanos. Sin embargo, estos modelos no representan la complejidad estructural y la funcionalidad de los mismos. En los últimos 15 años estos modelos han sido reemplazados paulatinamente por los cultivos tridimensionales que representan, con mucho mayor fidelidad, la complejidad, integridad, funcionalidad, linaje genético y otras características de los tejidos. La idea de desarrollar cultivos tridimensionales partió de la necesidad de mimetizar las condiciones naturales de los tejidos, creando complejas estructuras tridimensionales que permitieran la formación de gradientes bioquímicos, resultando en crecimiento celular direccionado, formando complejos y arreglos compartimentados con características casi idénticas o muy cercanas a las del tejido que se quiere representar.
Los modelos tridimensionales se distinguen de los cultivos bidimensionales en varias características: 1) incorporan más de un tipo celular, ya que utilizan células troncales capaces de diferenciarse en diversos linajes; 2) las células crecen en un soporte o matriz extracelular externa, que les confiere la tridimensionalidad, 3) requieren factores de crecimiento esenciales para la proliferación y diferenciación celular y 4), permiten las interacciones célula-célula y célula-matriz, resultando en una mejor representación del microambiente fisiológico del tejido de origen. A la fecha, se han desarrollado diversos tipos de cultivos tridimensionales, destacando los esferoides, organoides, órganos en chip y la bioimpresión, que se pueden organizar en función de su complejidad bioquímica y representatividad fisiológica.
En particular, los organoides o “mini-órganos”, son versiones reducidas de algún órgano de interés, generados a partir de células troncales (adultas, pluripotenciales inducidas o embrionarias) y crecidos en matrices de soporte como el matrigel, que es una matriz extracelular sintética que está compuesta por laminina, colágeno y entactina, entre otras proteínas, que le permiten a las células formar una estructura tridimensional Los organoides pueden emular al tejido que se quiere representar, como el corazón, cerebro o los intestinos, por mencionar algunos órganos, en condiciones de cultivo altamente específicas. Estos modelos tridimensionales tienen la capacidad de autorrenovarse y diferenciarse de manera similar a como ocurre en los órganos, por lo que su desarrollo y aplicación ha sido de gran interés para la comunidad científica del mundo, convirtiéndolos en el nuevo estándar de oro para el cultivo celular (Fig. 1).
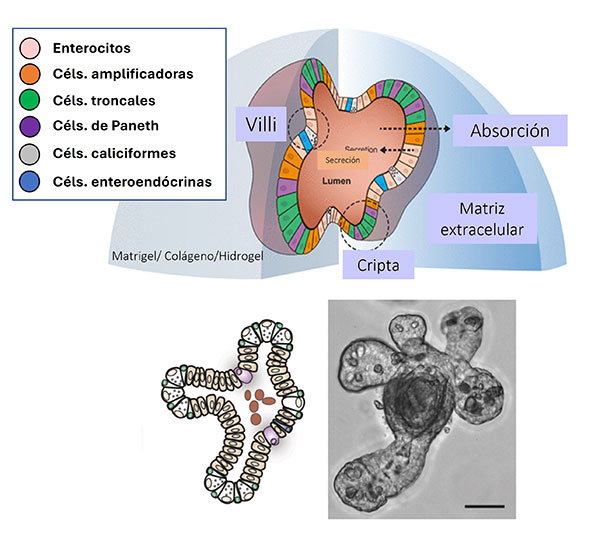
Fig. 1 Organoides intestinales. Estos modelos son desarrollados en matrigel, una matriz extracelular sintética que permite a las células crecer en tres dimensiones. Los organoides intestinales contienen todas las poblaciones celulares del epitelio intestinal y forman estructuras similares al tejido de origen. Creado en https://BioRender.com
El primer modelo de organoides intestinales fue desarrollado por Sato y colaboradores. (2009), quienes generaron organoides epiteliales (enteroides) con criptas y epitelio formando las características vellosidades intestinales. Para desarrollar este modelo se aislaron por primera vez las células madre intestinales que expresan el receptor acoplado a proteína G (Lgr5+), mismas que fueron sembradas en matrigel e inducidas a diferenciarse, permitiendo que se formaran los característicos nichos intestinales en tercera dimensión. A partir de ahí, se desencadenó el auge de los organoides con múltiples aplicaciones en la biomedicina, incluyendo estudios filogenéticos, pruebas de fármacos, ensayos de citotoxicidad, modelado de enfermedades crónico-degenerativas, edición genética, medicina regenerativa y de precisión, así como el estudio de las enfermedades infecciosas (Fig. 2).
[]
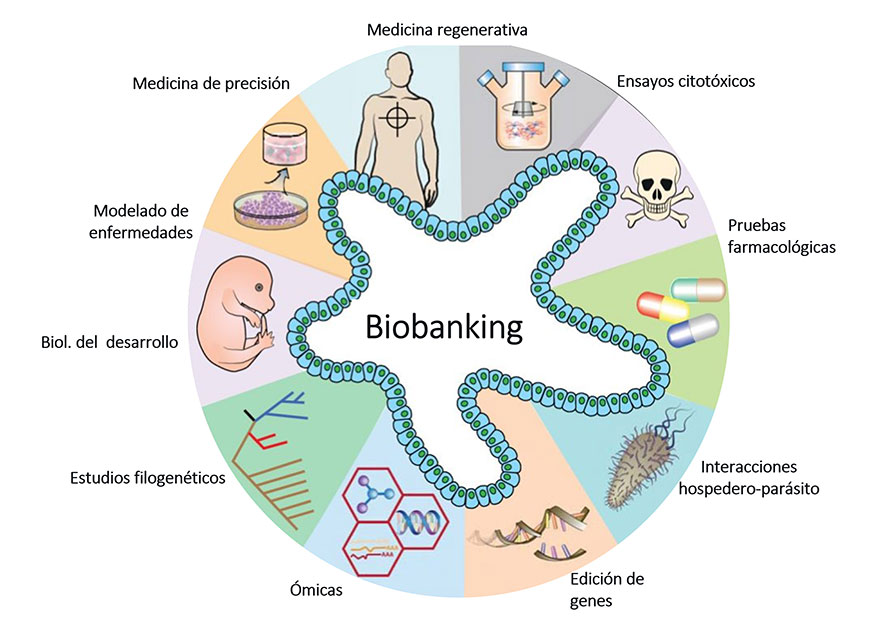
Fig. 2 Aplicaciones del modelo de organoides intestinales. Los organoides intestinales se han empleado en múltiples aplicaciones como el modelado de enfermedades, pruebas farmacológicas, interacciones con patógenos y hasta en la medicina personalizada. Creado en https://BioRender.com
El estudio de las enfermedades infecciosas históricamente había sido abordado mediante el uso de líneas celulares, para analizar la interacción con virus, bacterias y protistas; no obstante, en muchas ocasiones estas interacciones se veían limitadas por las características intrínsecas de la línea celular, su simplicidad y la poca semejanza con los modelos in vivo o los cultivos 3D. Por ejemplo, la infección con diversas cepas del parásito Giardia intestinalis ha sido modelada usando líneas como MDCK (riñón de mono), Caco2 (carcinoma de colon), IEC-6 (intestino de rata) e INT-407 (tejido intestinal embrionario), todas ellas funcionales y permisibles a la infección, pero no son el blanco celular natural del parásito. Por otra parte, se han usado diversos modelos in vivo para el estudio de la giardiasis, como la rata, el cerdo, el ratón, conejo y jerbo. Aunque este último es el modelo animal más funcional para representar la giardiasis experimental, sus diferencias con la infección humana son importantes, lo que complica su extrapolación a lo que ocurre de manera natural.
Para contrarrestar esas dificultades, las investigaciones sobre infecciones utilizan ahora modelos tridimensionales, como los organoides intestinales. Durante la pandemia de COVID 19 se requirió de la implementación de herramientas biotecnológicas para el estudio, monitoreo y entendimiento de las características funcionales y el tropismo celular del virus, así como la descripción de su patogénesis en múltiples órganos del humano, por lo que aquellos laboratorios que tenían en desarrollo organoides del tracto respiratorio, gastrointestinal y sistema circulatorio, no dudaron en utilizar sus plataformas para modelar los mecanismos de infección del virus SARS CoV2 e incluso para el desarrollo de potenciales prototipos vacunales, con la finalidad de salvar el mayor número de vidas posibles ante la emergencia sanitaria.
Si bien los organoides son excelentes plataformas para el estudio de las enfermedades infecciosas, también tienen sus dificultades. Uno de los principales problemas son las vías de infección o de inoculación del agente infeccioso. En el caso de los organoides intestinales, el lumen intestinal se encuentra en el centro del modelo, lo que dificulta la ruta de acceso de los patógenos. Para la infección de organoides intestinales con bacterias como Helicobacter pylori y Escherichia coli, por ejemplo, se tienen que usar técnicas de microinyección, de tal forma que el inóculo establezca contacto directo con las microvellosidades intestinales. Otra forma de infectarlos es haciendo organoides “apical-out”, lo que se podría traducir como “organoides volteados”, ya que la parte apical del epitelio queda expuesta en la superficie externa del organoide, de forma que los patógenos pueden ser inoculados en el matrigel y acceder fácilmente a las microvellosidades.
Una tercera forma de infección es desarrollando monocapas derivadas de organoides (conocidas como ODM, del inglés Organoid-derived monolayers), para representar de manera más precisa los epitelios y recrear un microambiente más efectivo para el estudio de infecciones in vitro. Las ODM se desarrollan a partir de células que provienen de organoides y que son sembradas en insertos tipo Transwell, permitiendo que se forme una monocapa abierta y expuesta, que puede ser inoculada con patógenos de mayor tamaño. Las monocapas derivadas de organoides han sido implementadas en el estudio de infecciones causadas por protistas como G. intestinalis, Toxoplasma gondii, Entamoeba histolytica, Crypstosporidium parvum, e incluso algunos nemátodos como Trichuris trichura.
Las infecciones virales han sido ampliamente estudiadas en los sistemas de monocapas en interfase aire-líquido conocido como ALI, del inglés Air-Liquid interface, principalmente aquellas que afectan a los tractos digestivo y respiratorio, como las causadas por los virus de influenza (IAV), rinovirus (RV), virus Nipah (NiV), virus de Epstein-Barr (EBV) e incluso el SARS-CoV-2.
En nuestro laboratorio, estamos desarrollando monocapas derivadas de organoides intestinales de ratón y de humano en el sistema ALI para que, además de tener la polaridad del epitelio intestinal, se induzca la formación de una capa de moco, que es una de las barreras que tienen que cruzar los pátogenos como G. intestinalis, antes de alojarse en el epitelio intestinal. Tanto las ODM como los sistemas en ALI tienen requerimientos que suponen un gran reto para los grupos de investigación, como es el uso de un gran número de células troncales para iniciar los cultivos, la elaboración de los componentes de los medios de cultivo específicos – como los medios inductores de diferenciación- que impactan directamente en las características del modelo y en la adecuada proliferación, migración, adhesión y supervivencia de las células (Fig. 3).
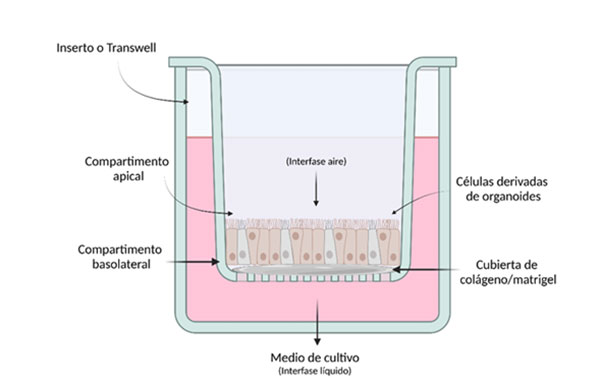
Fig. 3 Monocapas derivadas de organoides en interfase aire-líquido (ALI). El sistema ALI permite que las células se polaricen, exponiendo la región apical y facilitando la interacción con patógenos, células del sistema inmune, componentes de la microbiota, etc. La absorción de nutrientes ocurre por la región basolateral. Creado en https://BioRender.com
Las monocapas derivadas de organoides que desarrollamos en nuestro laboratorio son completamente confluentes a los 10 días de haber iniciado el cultivo ALI. Las monocapas forman un epitelio polarizado y hermético, capaz de producir moco y de expresar características morfológicas, como la compartimentación celular y la presencia de uniones estrechas, que semejan el epitelio de origen (Fig. 4). Este cultivo resultó apropiado para la infección por trofozoítos de G. intestinalis y permitió analizar la interacción entre el parásito, el moco y el epitelio, tal como sugiere la literatura que podría ocurrir durante la infección en el humano.
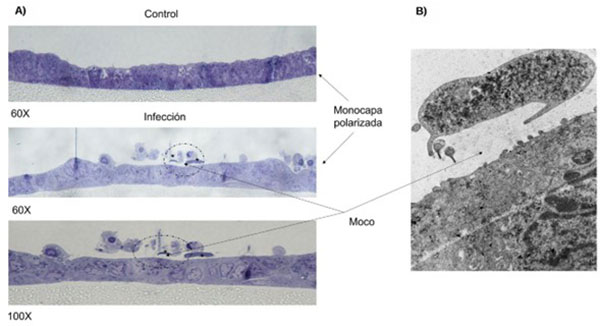
Fig. 4 Monocapas derivadas de organoides murinos infectadas con trofozoítos de G. intestinalis en el sistema ALI. A) Cortes semifinos teñidos con azul de Toluidina muestra la monocapa sin infectar ( control) y monocapas infectadas con el parásito. B) Micrografía de un trofozoíto de G. intestinalis infectando la monocapa derivada de organoides observadas por microscopía electrónica de transmisión.
(Acosta-Virgen, 2021, Tesis de doctorado)
Nuestros resultados coinciden con las investigaciones que se han desarrollado en otras partes del mundo, y confirman que la innovación en el cultivo celular con la implementación de los cultivos en tres dimensiones, ha revolucionado la forma en que estudiamos distintos tipos de enfermedades, incluyendo las infecciones, con modelos más representativos de los microambientes fisiológicos, lo cual nos permitirá en un futuro estudiar y desarrollar tratamientos más adecuados para el manejo y control de las enfermedades.
Lecturas adicionales:
Acosta Virgen Karla Berenice. 2021. Tesis de Doctorado. Cinvestav
Corrò, C., Novellasdemunt, L., & Li, V. S. W. (2020). A brief history of organoids. American Journal of Physiology-Cell Physiology, 319(1), C151–C165. https://doi.org/10.1152/ajpcell.00120.2020
Clevers, H. (2016). Modeling Development and Disease with Organoids. In Cell. https://doi.org/10.1016/j.cell.2016.05.082
Clevers, H. (2020). COVID-19: organoids go viral. In Nature Reviews Molecular Cell Biology. https://doi.org/10.1038/s41580-020-0258-4
Sato, T., Vries, R. G., Snippert, H. J., Van De Wetering, M., Barker, N., Stange, D. E., Van Es, J. H., Abo, A., Kujala, P., Peters, P. J., & Clevers, H. (2009). Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. https://doi.org/10.1038/nature07935
*Foto de portada creada con Chat GPT

Karla Berenice Acosta-Virgen

Adolfo Martínez-Palomo

Martha Espinosa Cantellano